第十二章 羧 酸
学习要求:
1、 掌握羧酸的命名,了解羧酸的物理性质和光谱性质;
2、 掌握羧酸的结构和化学性质;
3、 掌握羧酸的制备,了解羧酸的来源;
4、 掌握二元羧酸和取代酸的化学性质;
5、 了解一些重要的一元羧酸、二元羧酸和取代酸;
6、 理解酸碱理论在有机化学中的应用。
羧酸可看成是烃分子中的氢原子被羧基(-COOH)取代而生成的化合物。其通式为RCOOH。羧酸的官能团是羧基。
羧酸是许多有机物氧化的最后产物,它在自然界普遍存在(以酯的形式),在工业、农业、医药和人们的日常生活中有着广泛的应用。
§ 12~1 羧酸的分类和命名
一、 分类
1.按烃基的种类可分为:
a.脂肪族羧酸:饱和羧酸、不饱和羧酸
b、脂环族羧酸
2.按羧基数目可分为:一元羧酸、二元羧酸、多元羧酸
| 饱和酸 | 不饱和酸 | 芳香酸 |
一元酸 | 乙酸 | 丙烯酸 | 苯甲酸 |
二元酸 | 乙二酸 | 顺丁烯二酸 | 邻二苯甲酸 |
二、命名
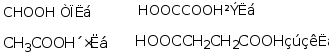 1.据来源命名
1.据来源命名

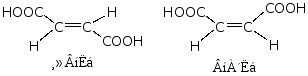
2.系统命名
a.含羧基的最长碳链。
b.编号。从羧基C原子开始编号。(用阿拉伯数字或希腊字母。)
c. 如有不饱和键角要标明烯(或炔)键的位次。并主链包括双键和叁键。
d. 脂环族羧酸。简单的在脂环烃后加羧酸二字,复杂的环可作为取代基。
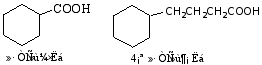
![]()
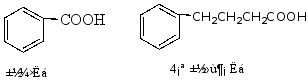
e.芳香酸可作脂肪酸的芳基取代物命名。
f.多元羧酸:选择含两个羧基的碳链为主链,按C原子数目称为某二酸。
§ 12~2 饱和一元羧酸的物理性质和光谱性质
一、物理性质
1.物态
C1~C3 有刺激性酸味的液体,溶于水。
C4~C9 有酸腐臭味的油状液体(丁酸为脚臭味),难溶于水。
> C9 腊状固体,无气味。
2.熔点
有一定规律,随着分子中碳原子数目的增加呈锯齿状的变化。
乙酸熔点16.6℃,当室温低于此温度时,立即凝成冰状结晶,故纯乙酸又称为冰醋酸。
3.沸点
比相应的醇的沸点高。见P356 表12-1
原因: 通过氢键形成二聚体。
二、羧酸的光谱性质
IR:反映出-C=O和-OH的两个官能团
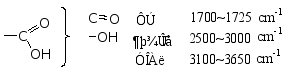
1HNMR: -COO-H δ= 10.5 ~ 12
§ 12~3 羧酸的化学性质
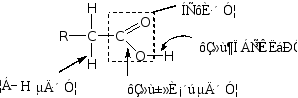
羧酸是由羟基和羰基组成的,羧基是羧酸的官能团,因此要讨论羧酸的性质,必须先剖析羧基的结构。

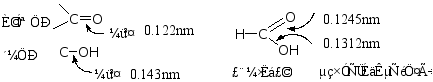
故羧基的结构为一 P-π共轭体系。
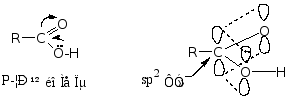
当羧基电离成负离子后,氧原子上带一个负电荷,更有利于共轭,故羧酸易离解成负离子。
![]()
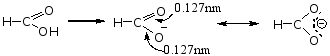 例如:
例如:
由于共轭作用,使得羧基不是羰基和羟基的简单加合,所以羧基中既不存在典型的羰基,也不存在着典型的羟基,而是两者互相影响的统一体。
羧酸的性质可从结构上预测,有以下几类:
一、酸性
羧酸具有弱酸性,在水溶液中存在着如下平衡:
![]()
乙酸的离解常数Ka为1.75×10-5
甲酸的Ka=2.1×10-4 , pKa =3.75
其他一元酸的Ka在1.1~1.8×10-5之间, pKa在4.7~5之间。
可见羧酸的酸性小于无机酸而大于碳酸(H2CO3 pKa1=6.73)。
故羧酸能与碱作用成盐,也可分解碳酸盐。
![]()
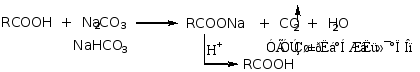
此性质可用于醇、酚、酸的鉴别和分离,不溶于水的羧酸既溶于NaOH也溶于NaHCO3,不溶于水的酚能溶于NaOH不溶于NaHCO3,不溶于水的醇既不溶于NaOH也溶于NaHCO3。
![]() RCOOH + NH4OH RCOONH4 + H2O
RCOOH + NH4OH RCOONH4 + H2O
高级脂肪酸高级脂肪酸钠是肥皂的主要成分,高级脂肪酸铵是雪花膏的主要成分。
影响羧酸酸性的因素:
影响羧酸酸性的因素复杂,这里主要讨论电子效应和空间效应。
1. 电子效应对酸性的影响
1)诱导效应
1°吸电子诱导效应使酸性增强。
FCH2COOH > ClCH2COOH > BrCH2COOH > ICH2COOH > CH3COOH
pKa值 2.66 2.86 2.89 3.16 4.76
2°供电子诱导效应使酸性减弱。
CH3COOH > CH3CH2COOH > (CH3)3CCOOH
pKa值 4.76 4.87 5.05
3°吸电子基增多酸性增强。
ClCH2COOH > Cl2CHCOOH > Cl3CCOOH
pKa值 2.86 1.29 0.65
4°取代基的位置距羧基越远,酸性越小。
![]()
pKa值 2.86 4.41 4.70 4.82
2) 共轭效应
当能与基团共轭时,则酸性增强,例如:
CH3COOH Ph-COOH
pKa值 4.76 4.20
2.取代基位置对苯甲酸酸性的影响
取代苯甲酸的酸性与取代基的位置、共轭效应与诱导效应的同时存在和影响有关,还有场效应的影响,情况比较复杂。 可大致归纳如下:
a 邻位取代基(氨基除外)都使苯甲酸的酸性增强(位阻作用破坏了羧基与苯环的共轭)。
b 间位取代基使其酸性增强。见P361表12~3
c 对位上是第一类定位基时,酸性减弱;是第二类定位基时,酸性增强。见表12~3。
二、羧基上的羟基(OH)的取代反应
羧基上的OH原子团可被一系列原子或原子团取代生成羧酸的衍生物。

![]()
羧酸分子中消去OH基后的剩下的部分( )称为酰基。
1.酯化反应
![]()
(1) 酯化反应是可逆反应,Kc≈4,一般只有2/3的转化率。
提高酯化率的方法:a 增加反应物的浓度(一般是加过量的醇)
b 移走低沸点的酯或水
(2) 酯化反应的活性次序:
酸相同时 CH3OH > RCH2OH > R2CHOH > R3COH
醇相同时 HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
(3) 成酯方式
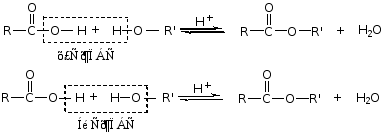
Ⅰ
Ⅱ
![]() 验证:
验证:
H2O中无O18,说明反应为酰氧断裂。
(4)酯化反应历程
1°、2°醇为酰氧断裂历程,3°醇(叔醇)为烷氧断裂历程。P363
(5) 羧酸与醇的结构对酯化速度的影响:
对酸:HCOOH > 1°RCOOH > 2°RCOOH > 3°RCOOH P363表12-4
对醇:1°ROH > 2°ROH > 3°ROH
2.酰卤的生成
羧酸与PX3、PX5、SOCl2作用则生成酰卤。见P364
三种方法中,方法3的产物纯、易分离,因而产率高。是一种合成酰卤的好方法。
![]()
![]()
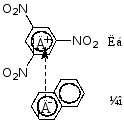
![]() 例如m-NO2C6H4COOH + SOCl2 m-NO2C6H4COCl + SO2 + HCl
例如m-NO2C6H4COOH + SOCl2 m-NO2C6H4COCl + SO2 + HCl
90%
![]()
![]()
![]() CH3COOH + SOCl2 CH3COCl + SO2 + HCl
CH3COOH + SOCl2 CH3COCl + SO2 + HCl
100%
3.酸酐的生成
酸酐在脱水剂作用下加热,脱水生成酸酐。
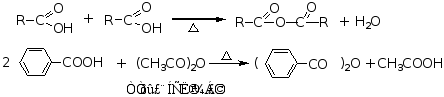
因乙酐能较迅速的与水反应,且价格便宜,生成的乙酸有易除去,因此,常用乙酐作为制备酸酐的脱水剂。
1,4和1,5二元酸不需要任何脱水剂,加热就能脱手生成环状(五元或六元)酸酐。
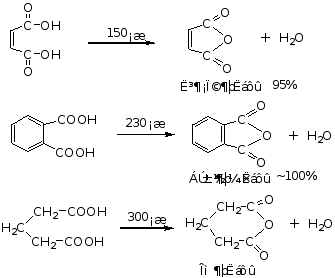 例如:℃
例如:℃
4.酰胺的生成
在羧酸中通入氨气或加入碳酸铵,可得到羧酸铵盐,铵盐热解失水而生成酰胺。Δ
![]()
三、脱羧反应
羧酸在一定条件下受热可发生脱羧反应
无水醋酸钠和碱石灰混合后强热生成甲烷,是实验室制取甲烷的方法。
![]()
其他直链羧酸盐与碱石灰热熔的产物复杂,无制备意义。
![]()
一元羧酸的α碳原子上连有强吸电子集团时,易发生脱羧。
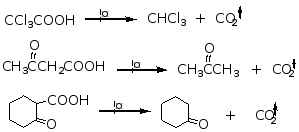 例如:
例如:
洪塞迪克尔(Hunsdiecker)反应, 羧酸的银盐在溴或氯存在下脱羧生成卤代烷的反应。
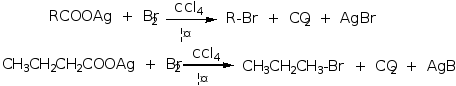
此反应可用来合成比羧酸少一个碳的卤代烃。
四、α-H的卤代反应
羧酸的α-H可在少量红磷、硫等催化剂存在下被溴或氯取代生成卤代酸。
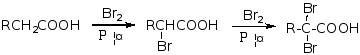
控制条件,反应可停留在一取代阶段。例如:
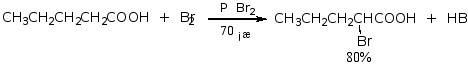
α-卤代酸很活泼,常用来制备α-羟基酸和α-氨基酸。
五、羧酸的还原
羧酸很难被还原,只能用强还原剂LiAlH4才能将其还原为相应的伯醇。H2/Ni、NaBH4等都不能使羧酸还原。
§ 12~4 羧酸的来源和制备
来源: 羧酸广泛存在与自然界,常见的羧酸几乎都有俗名。自然界的羧酸大都以酯的形式存在于油、脂、蜡中。油、脂、蜡水解后可以得到多种羧酸的混合物。
制法:
一、氧化法
1. 醛、伯醇的氧化
2. 烯烃的氧化(适用于对称烯烃和末端烯烃)
3. 芳烃的氧化(有α-H芳烃氧化为苯甲酸)
4. 碘仿反应制酸(用于制备特定结构的羧酸)P369
二、羧化法
1. 格式试剂合成法
格式试剂与二氧化碳加合后,酸化水解得羧酸。
![]()
1°、2°、3°RX都可使用。
此法用于制备比原料多一个碳的羧酸,但乙烯式卤代烃难反应。
2.烯烃羰基化法
烯烃在Ni(CO)4催化剂的存在下吸收CO和H2O而生成羧酸。P369
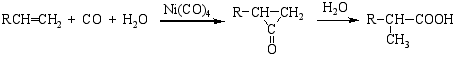
三、水解法
1.睛的水解 (制备比原料多一个碳的羧酸)
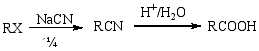
此法仅适用于1°RX(2°、3°RX 与NaCN作用易发生消除反应)。
2. 羧酸衍生物的水解
油脂和羧酸衍生物得羧酸,及副产物甘油和醇。
3.通过丙二酸二乙酯合成各种羧酸。P405~406
§ 12~5 重要的一元羧酸
 一、甲酸
一、甲酸
1.结构
2.特性
① 甲酸的酸性显著高于其它饱和一元酸
② 甲酸具有还原性,能发生银镜反应。
③ 甲酸也能使高锰酸钾溶液退色。
④ 甲酸具有杀菌力,可作消毒或防腐剂。
⑤ 甲酸与浓硫酸加热,则分解生成一氧化碳和水。
![]() 二、乙酸
二、乙酸
三、苯甲酸
§ 12~6 二元羧酸
一、物理性质
1.物态 二元羧酸都是固态晶体,熔点比相近分子量的一元羧酸高得多。
2.溶解度 比相应的一元酸大,易溶于乙醇,难溶于其他有机溶剂。
二、二元羧酸的化学性质
1.具有羧酸的通性
对酸性而言 pKa1 > pKa2 原因P371~372。
2.二元羧酸受热反应的规律
(1) 乙二酸、丙二酸受热脱羧生成一元酸,

(2)丁二酸、戊二酸受热脱水(不脱羧)生成环状酸酐,
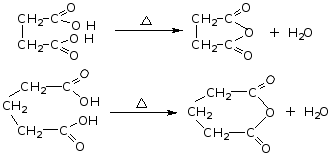
 例如:
例如:
(3)己二酸、庚二酸受热既脱水又脱羧生成环酮,
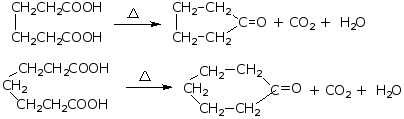
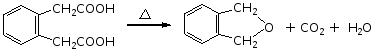 例如:
例如:
3.与二元醇反应
二元酸与二元醇反应可生成环酯(但仅限于五元环或六元环),也可以生成聚酯。P373
三、重要的二元羧酸
1.草酸(乙二酸):具有还原性,易被氧化成二氧化碳和水。
2.已二酸
3.癸二酸
4.丁烯二酸:顺反异构体。
① 熔点 反式 〉顺式
② 燃烧热 顺式 〉反式 (顺式没有反式稳定)
③ 酸性: Ka1 顺式 〉反式; Ka2 反式 〉顺式
④ 顺、反的关系
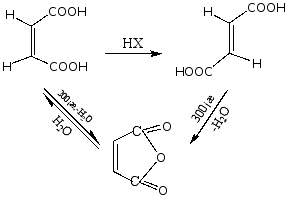
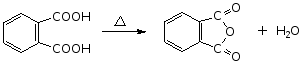
5.邻苯二甲酸
§ 12~7 取代羧酸
羧酸分子中烃基上的氢原子被其他原子或原子团取代后形成的化合物称为取代酸。
取代酸有卤代酸、羟基酸、氨基酸、羰基酸等,其中卤代酸、氨基酸将在有关章节中讨论,这里只讨论羟基酸和羰基酸。
一、羟基酸
1.制法
(1)卤代酸水解 用碱或氢氧化银处理α,β,γ等卤代酸时可生成对应的羟基酸。
![]() 例如:
例如:
(2) 氰醇水解 制α-羟基酸
![]()
(3)列佛尔曼斯基(Reformatsky)反应 制备β-羟基酸的方法。
α-卤代酸酯在锌粉作用下与醛、酮反应,生成β-羟基酸酯,β-羟基酸酯水解生成
β-羟基酸。
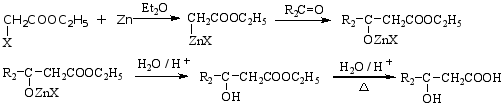
2.羟基酸的性质
具有醇和酸的共性,也有因羟基和羧基的相对位置的互相影响的特性反应。主要表现在受热反应规律上。
α-羟基酸受热时,两分子间相互酯化,生成交酯。
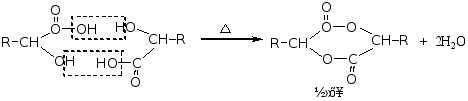
讨论: 写出下列反应的产物℃
![]() 1°
1°
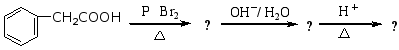
2°
β-羟基酸受热发生分子内脱水,主要生成α-β不饱和羧酸。
![]()
讨论:下列反应的产物是?
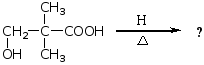
γ-和δ-羟基酸受热,生成五元和六元环内酯。
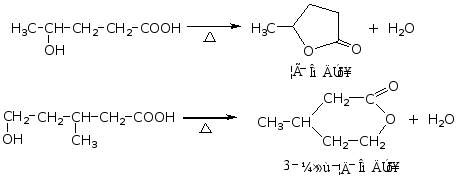
羟基与羧基间的距离大于四个碳原子时,受热则生成长链的高分子聚酯。P376
α-和β-羟基酸还有羟基被氧化后在脱羧的性质。P377
3.重要的羟基酸 (自学)
二、 羰基酸
分子中含有羰基,有含有羧基的化合物称为羰基酸,如丙酮酸、3-丁酮酸等。
1. 羰基酸具有羰基和羧酸的典型反应。
2. 酮酸的特性反应
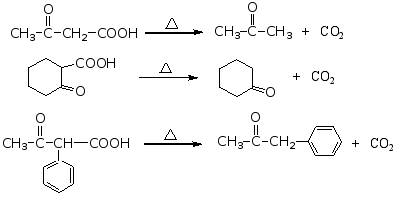
α-与稀硫酸共热时,脱羧生成醛。
β-酮酸受热易脱羧生成酮。
§ 12-8 酸碱理论
一、 布伦斯特酸碱理论
 1.定义:凡是能释放质子的任何分子或离子都是酸;碱就是能与质子化合的分子或离子。
1.定义:凡是能释放质子的任何分子或离子都是酸;碱就是能与质子化合的分子或离子。
2.布伦斯特酸碱是相对的。
水对CH3COOH来说是碱,但水对CH3COO-来说是酸。
![]()
![]() 水对NH4+来说是碱,水对NH3来说是酸
水对NH4+来说是碱,水对NH3来说是酸
![]()
![]()
![]()
3.酸碱强度
![]()
![]()
![]()
![]()
![]()
布伦斯特酸碱理论在有机化学中是非常有用的,应该注意到酸碱的强弱与亲电、亲核试剂的强度并不完全一致,这是因为布伦斯特酸碱强弱与平衡常数有关,而亲电、亲核试剂强弱与反应活化能有关。碱是接受质子的能力,而亲核试剂是和碳的结合能力。
一般来说,酸是一种亲电试剂,而碱是一种亲核试剂,但是S2-,CN-,I-等强的亲核试剂并不一定是强碱,而强的亲电试剂也并不一定是强酸(如Br2,Cl2)
二、路易斯酸碱理论
1.定义:酸是可以接受外来电子对的任何分子、基团或离子,所以路易斯酸又称电子对的接受体。碱是含有可以给予电子对的分子、基团或离子,所以路易斯碱又称电子对的给予体
2.路易斯酸碱应用范围更广泛。路易斯酸碱实际上是含有外层能接受电子对(或能给出电子对)的原子或原子团的物质。
路易斯把酸碱看作为电子授受过程,而电子授受过程又是在化学反应中经常发生的,因此路易斯的酸碱应用更广泛。
3.路易斯酸碱
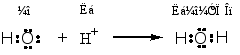 ① 酸碱加合物
① 酸碱加合物
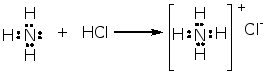
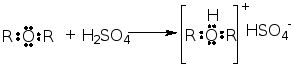
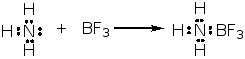
② 路易斯酸:包括质子酸(H+、HCl、H2SO4……)、具有可以接受电子对的空轨道的分子(BF3、AlCl3、SnCl4、ZnCl2、FeCl3……)以及正离子(Na+、Ca2+、Fe3+……)。
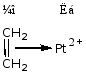 ③ 路易斯碱:包括阴离子(HO-、CH3O-、Cl-、……)、中性具有未共用电子对的分子(H2O、R2O、RNH2……)以及具有π电子的不饱和烃和芳烃。
③ 路易斯碱:包括阴离子(HO-、CH3O-、Cl-、……)、中性具有未共用电子对的分子(H2O、R2O、RNH2……)以及具有π电子的不饱和烃和芳烃。
·1·