第八章 芳 烃
学习要求:
1.掌握芳香烃及其衍生物的命名。
2.理解苯环的结构特征,能用价键理论说明苯的结构。
3.掌握苯及其同系物的化学性质。
4.熟悉苯环上亲电取代反应历程,能熟练应用取代基定位规律。
5.熟悉萘的结构与性质,了解几种多环芳烃。
6.掌握休克尔规则,会判断非苯芳烃。
芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。
芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含有苯环结构。
芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。
芳烃按其结构可分类如下:

一、苯及其同系物
(一)苯的结构
1.凯库勒结构式
1865年凯库勒从苯的分子式C6H6出发,根据苯的一元取代物只有一种(说明六个氢原子是等同的事实,提出了苯的环状构造式。
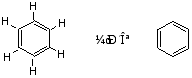
苯的凯库勒式结构
2.苯分子结构的价键观点
现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是一个平面正六边形构型,键角都是120°,碳碳键长都是0.1397nm。图示如下:

理论解释:
(1)杂化轨道理论解释
苯分子中的碳原子都是以sp2杂化轨道成键的,故键角均为120°,所有原子均在同一平面上。
未参与杂化的P轨道都垂直与碳环平面,彼此侧面重叠,形成一个封闭的共轭体系,由于共轭效应使π电子高度离域,电子云完全平均化,故无单双键之分。

(2)分子轨道理论解释
 分子轨道理论认为,分子中六个P轨道线形组合成六个π分子轨道,其中三个成键规定,三个反键轨道。在基态时,苯分子的六个π电子成对填入三个成键轨道,其能量比原子轨道低,所以苯分子稳定,体系能量 较低 。
分子轨道理论认为,分子中六个P轨道线形组合成六个π分子轨道,其中三个成键规定,三个反键轨道。在基态时,苯分子的六个π电子成对填入三个成键轨道,其能量比原子轨道低,所以苯分子稳定,体系能量 较低 。
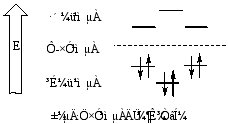
苯分子的大π键是三个成键轨道叠加的结果,由于π电子都是离域的,所以碳碳键长完全相同。
从氢化热看苯的稳定性
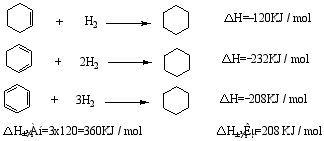
苯的稳定化能(离域能或共振能)=360-208=152KJ/mol
3.苯的共振式和共振论的简介
(1)基本要点:
a. 当一个分子、离子或游离基按照理论可以写出两个以上经典结构式时,这些经典结构式构成了一个共振杂化体,共振杂化体接近实际分子。
![]()
b.书写极限式时,必须严格遵守经典原子结构理论。原子核的相对位置不能改变,只允许电子排布上有所差别。
![]()

c.在所有极限式中,未共用的电子数必须相等。
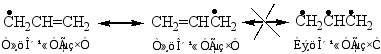
d.分子的稳定程度可用共振能表示。
苯的共振能为150.4 KJ/mol
(2)共振论解释苯的结构
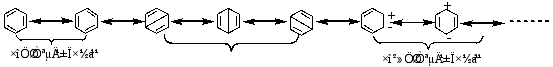
![]()
(二)单环芳烃的异构和命名
一)异构现象
 1.烃基苯有烃基的异构
1.烃基苯有烃基的异构
例如:
![]() 2.二烃基苯有三中位置异构
2.二烃基苯有三中位置异构
例如:
1.三取代苯有三中位置异构
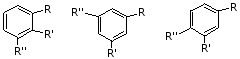 例如:
例如:
二) 命名
1.基的概念
芳烃分子去掉一个氢原子所剩下的基团称为芳基(Aryl)用Ar表示。重要的芳基有:
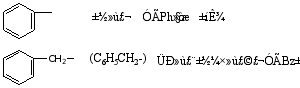
2.一元取代苯的命名
a 当苯环上连的是烷基(R-),-NO2,-X等基团时,则以苯环为母体,叫做某基苯。
 例如:
例如:
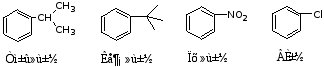
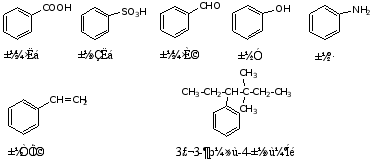 b 当苯环上连有-COOH,-SO3H,-NH2,-OH,-CHO,-CH=CH2或R较复杂时,则把苯环作为取代基。例如:
b 当苯环上连有-COOH,-SO3H,-NH2,-OH,-CHO,-CH=CH2或R较复杂时,则把苯环作为取代基。例如:
3.二元取代苯的命名
取代基的位置用邻、间、对或1,2; 1,3; 1,4表示。
例如:
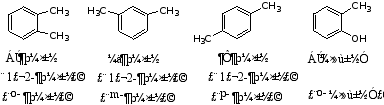
2.多取代苯的命名
a 取代基的位置用邻、间、对或2,3,4,……表示
b 母体选择原则(按以下排列次序,排在后面的为母体,排在前面的作为取代基。)
选择母体的顺序如下:
-NO2、 -X、 -OR(烷氧基)、 -R(烷基)、 -NH2、 -OH、 -COR、 -CHO、 -CN、
-CONH2(酰胺)、 -COX(酰卤)、 -COOR(酯)、 -SO3H、 -COOH、 -N+R3等
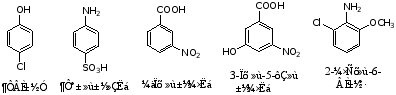 例如:
例如:
(三)单环芳烃的性质
芳烃的化学性质主要是芳香性,即易进行取代反应,而难进行加成和氧化反应。
一) 亲电取代反应
1.硝化反应
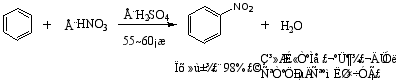
浓H2SO4的作用——促使+NO2离子(硝基正离子)的生成,其反应式见P157。
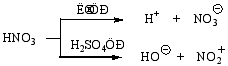
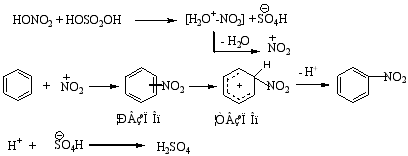
硝化反应历程:
硝基苯继续硝化比苯困难
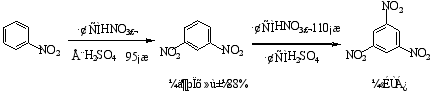
烷基苯比苯易硝化

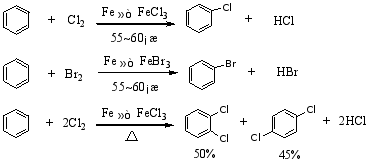
2.卤代反应
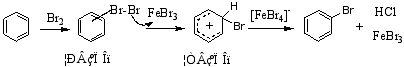 反应历程:
反应历程:
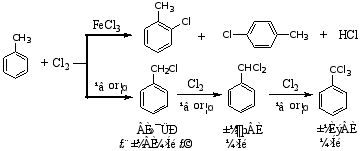 烷基苯的卤代
烷基苯的卤代
反应条件不同,产物也不同。因两者反应历程不同,光照卤代为自由基历程,而前者为离子型取代反应。
侧链较长的芳烃光照卤代主要发生在α碳原子上。
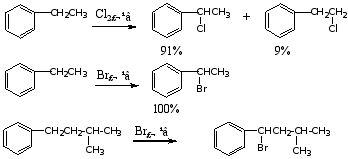
3.磺化反应
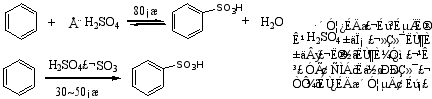
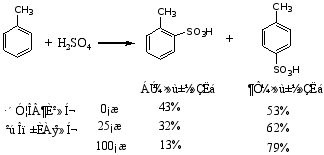 烷基苯比苯易磺化
烷基苯比苯易磺化
磺化反应是可逆的,苯磺酸与稀硫酸共热时可水解脱下磺酸基。
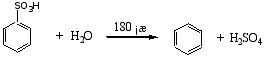
此反应常用于有机合成上控制环上某一位置不被其它基团取代,或用于化合物的分离和提纯。
磺化反应历程:
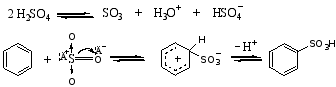
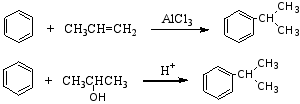
4.付瑞德—克拉夫茨(C.Friede —J.M.Crafts)反应
1877年法国化学家付瑞德和美国化学家克拉夫茨发现了制备烷基苯和芳酮的反应,简称为付—克反应。前者叫付—克烷基化反应,后者叫付—克酰基化反应。
(1) 烷基化反应
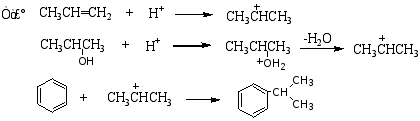
苯与烷基化剂在路易斯酸的催化下生成烷基苯的反应称为付—克烷基化反应。
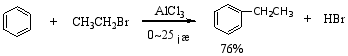
反应历程:
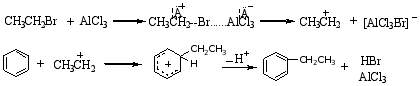
此反应中应注意以下几点:
1°常用的催化剂是无水AlCl3,此外 FeCl3、BF3、无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催化作用。
2°当引入的烷基为三个碳以上时,引入的烷基会发生碳链异构现象。
例如:
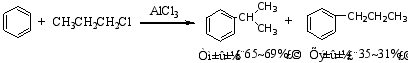
原因:反应中的活性中间体碳正离子发生重排,产生更稳定的碳正离子后,再进攻苯环形成产物。
3°烷基化反应不易停留在一元阶段,通常在反应中有多烷基苯生成。
4°苯环上已有–NO2、-SO3H、-COOH、-COR等取代基时,烷基化反应不在发生。因这些取代基都是强吸电子基,降低了苯环上的电子云密度,使亲电取代不易发生。例如,硝基苯就不能起付—克反应,且可用硝基苯作溶剂来进行烷基化反应。
5°烷基化试剂也可是烯烃或醇。
 例如:
例如:
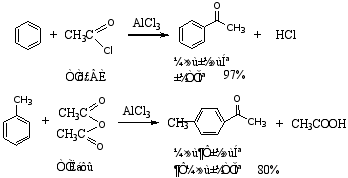 (2) 酰基化反应
(2) 酰基化反应
酰基化反应的特点:产物纯、产量高(因酰基不发生异构化,也不发生多元取代)。
3.苯环的亲电取代反应历程
苯及同系物的取代反应都是亲电取代历程,其里程可用通式表示如下:
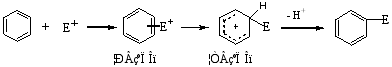
实验证明,硝化、磺化和氯代是只形成σ络合物的历程,溴化是先形成π络合物,再转变为σ络合物的历程。
二)加成反应
![]() 苯环易起取代反应而难起加成反应,但并不是绝对的,在特定条件下,也能发生某些加成反应。
苯环易起取代反应而难起加成反应,但并不是绝对的,在特定条件下,也能发生某些加成反应。
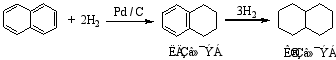
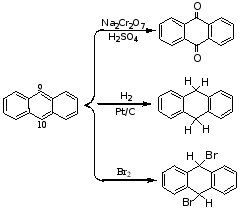
1.加氢
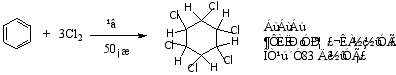
2.加氯
三)氧化反应
苯环一般不易氧化,在特定激烈的条件下,苯环可被氧化破环。例如:

![]()
烷基苯(有α-H时)侧链易被氧化成羧酸。
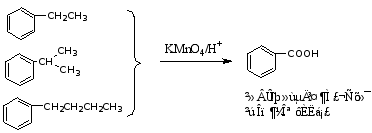
若两个烃基处在邻位,氧化的最后产物是酸酐。例如:
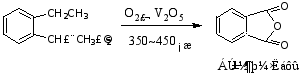
当与苯环相连的侧链碳(α-C)上无氢原子(α-H)时,该侧链不能被氧化。
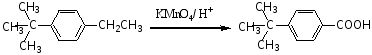 例如:
例如:
(四)取代苯的亲电取代反应的活性和定位规律
一取代苯有两个邻位,两个间位和一个对位,在发生一元亲电取代反应时,都可接受亲电试剂进攻,如果取代基对反应没有影响,则生成物中邻、见间、对位产物的比例应为2:2:1。但从前面的性质讨论可知,原有取代基不同,发生亲电取代反应的难易就不同,第二个取代基进入苯环的相对位置也不同。例如:
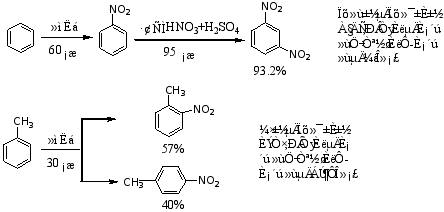
可见,苯环上原有取代基决定了第二个取代基进入苯环位置的作用,也影响着亲电取代反应的难易程度。我们把原有取代基决定新引入取代基进入苯环位置的作用称为取代基的定位效应。
一)三类定位基
根据原有取代基对苯环亲电取代反应的影响——即新引入取代基导入的位置和反应的难易分为三类。
1.邻、对位定位基
使新引入的取代基主要进入原基团邻位和对位(邻对位产物之和大于60%),且活化苯环,使取代反应比苯易进行。
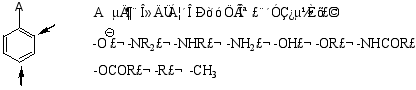
2.间位定位基
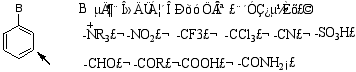 使新引入的取代基主要进入原基团间位(间位产物大于50%),且钝化苯环,使取代反应比苯难进行。
使新引入的取代基主要进入原基团间位(间位产物大于50%),且钝化苯环,使取代反应比苯难进行。
3.第三类定位基(此类主要是指卤素及-CH2Cl等)
使新引入的取代基主要进入原基团邻位和对位,但使苯环略微钝化,取代反应比苯难进行。
二)定位效应的解释
苯环上取代基的定位效应,可用电子效应解释,也可从生成的σ络合物的稳定性来解释,还有空间效应的影响。
![]() A.用电子效应解释
A.用电子效应解释
苯环是一个对称分子,由于苯环上π电子的高度离域,苯环上的电子云密度是完全平均分布的,但苯环上有一个取代基后,由于取代基的影响,环上的电子云分布就发生了变化,出现电子云密度较大与较小的交替现象,于是,进行亲电取代反应的难易程度就不同,进入的位置也不同。
1.对间位基的解释 (以硝基苯为例)

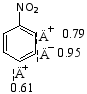 -I、-C方向都指向苯环外的硝基(电荷密度向硝基分布)使苯环钝化,因间位的电荷密度降低的相对少些,故新导入基进入间位。
-I、-C方向都指向苯环外的硝基(电荷密度向硝基分布)使苯环钝化,因间位的电荷密度降低的相对少些,故新导入基进入间位。
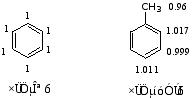
硝基苯苯环上的相对电荷密度为:
2.对邻、对位基的解释
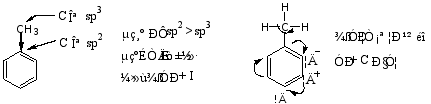 1) 甲基和烷基
1) 甲基和烷基
 诱导效应+I和共轭效应+C都使苯环上电子云密度增加,邻位增加的更多,量子化学计算的结果如下:
诱导效应+I和共轭效应+C都使苯环上电子云密度增加,邻位增加的更多,量子化学计算的结果如下:
故甲基使苯环活化,亲电取代反应比苯易进行,主要发生在邻、对位上。
2) 具有孤电子对的取代基(-OH、-NH2、-OR等)
以苯甲醚为例:
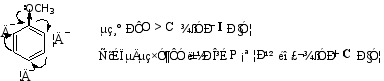
由于+C > -I,所以苯环上的电荷密度增大,且邻、对位增加的更多些,故为邻对位定位基。
3.第三类定位基(卤素)定位效应的解释 见P172
B. 用生成的σ-络合物的稳定性解释
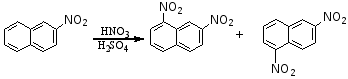
1.从硝基苯硝化时可能生成的三种σ-络合物来看
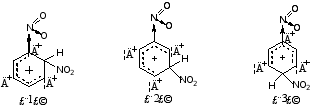
三个σ-络合物中(2)比(1)和(3)稳定,因硝基和带部分正电荷的碳原子不直接相连,而(1)和(3)中,硝基和带部分正电荷的碳原子直接相连。硝基的吸电子作用,使得(1)和(3)中正电荷比(2)更集中些,因此,(1)和(3)不如(2)稳定,亲电试剂正离子进攻邻对位所需要的能垒较间位达到高,故产物主要是间位的。
2.从苯甲醚亲电取代时可能生成的三种σ-络合物看
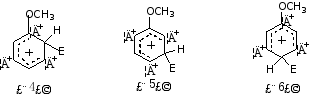
CH3O-能分散(4)、(6)的正电荷,使σ-络合物更稳定,能量低,易生成,故CH3O-为邻对位基。
三)、取代定位效应的应用
1.预测反应的主要产物
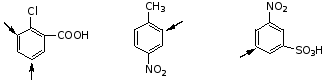
苯环上以有两个取代基时,引入第三个取代基时,有下列几种情况:
(1)原有两个基团的定位效应一致,例如:
 (2)原有两个取代基同类,而定位效应不一致,则主要由强的定位基指定新导入基进入苯环的位置。例如:
(2)原有两个取代基同类,而定位效应不一致,则主要由强的定位基指定新导入基进入苯环的位置。例如:
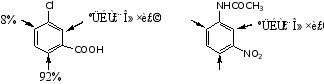 (3)原有两个取代基不同类,且定位效应不一致时,新导入基进入苯环的位置由邻对位定位基指定。例如:
(3)原有两个取代基不同类,且定位效应不一致时,新导入基进入苯环的位置由邻对位定位基指定。例如:
2.指导选择合成路线
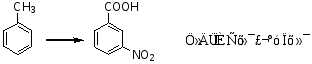 例1:
例1:

例2:
路线一:先硝化,后氧化
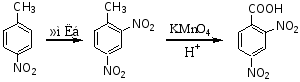
路线二:先氧化,后硝化
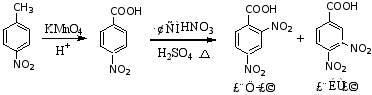
路线二有两个缺点,(1)反应条件高,(2)有付产物,所以路线一为优选路线。
二、多环芳烃和非苯芳烃
(一) 稠环芳烃
 萘
萘
一)萘的结构
平面结构,所有的碳原子都是sp2杂化的,是大π键体系。
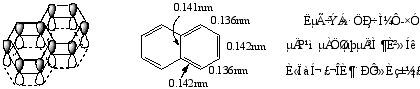
分子中十个碳原子不是等同的,为了区别,对其编号如下:
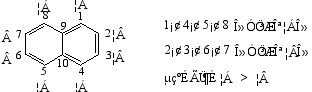
萘的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。
二)萘的反应和用途
1.加成反应
萘比苯易加成,在不同的条件下,可发生部分或全部加氢。
2.氧化反应
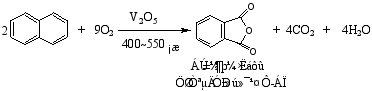 萘比苯易氧化
萘比苯易氧化


3.取代反应
(1)消化 萘与混酸在常温下就可以反应,产物几乎全是α-硝基萘。
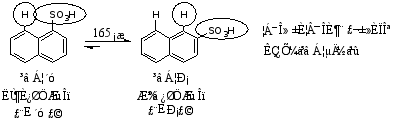
(2)磺化反应
磺化反应的产物与反应温度有关。低温时多为α-萘磺酸,较高温度时则主要是β-萘磺酸,α-萘磺酸在硫酸里加热到165℃时,大多数转化为β-异构体。其反应式如下:

高温生成β-异构体的原因:
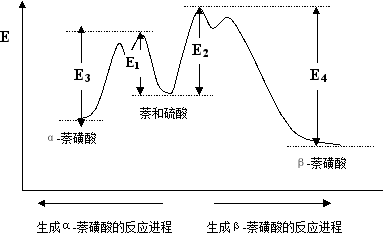
萘的磺化反应是一个竞争反应,如何控制呢?请看能量曲线:
正反应: E1 < E2
逆反应: E3 < E4
萘环上的定位规则
 · 如萘环上的α位上已有一个第一定位基,第二个取代基进入萘环的4位(多)和2位(少)。
· 如萘环上的α位上已有一个第一定位基,第二个取代基进入萘环的4位(多)和2位(少)。
·· 如萘环上β位有第一类定位基,第二个取代基主要进入1位。
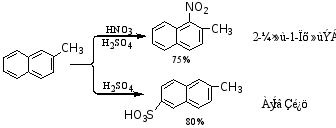
 ··· 如萘环上α或β位上有第二类定位基,第二个取代基主要进入另一个苯环的5、8位。
··· 如萘环上α或β位上有第二类定位基,第二个取代基主要进入另一个苯环的5、8位。
萘环的取代比较复杂,受条件、试剂的影响很大,例外的情况较多。
蒽
主要存于煤焦油中,分子式C14H10,是菲的同分异构体。
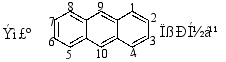 9、10位相同称γ-位;
9、10位相同称γ-位;
1、4、5、8位称α-位;
 2、3、6、7位称β-位。
2、3、6、7位称β-位。
菲
 主要存于煤焦油中,分子式C14H10,是蒽的同分异构体。
主要存于煤焦油中,分子式C14H10,是蒽的同分异构体。
1和8相同;2和7相同;3和6相同;4和5相同;9和10相同。
(二)联苯
![]() 1.结构
1.结构
2.制备
3.性质 稳定,可发生亲电取代反应。
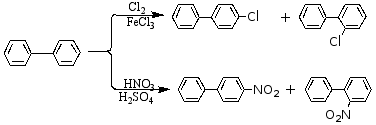
① 原取代基是邻、对位定位基,则进入同环。
② 原取代基是间位定位基,则进入异环。
③ 联苯的沸点较高,不易着火,对热很稳定,常用作传热载体。
二、三苯甲烷和稳定的碳正离子,碳负离子、碳游离基
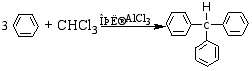 1.制备
1.制备
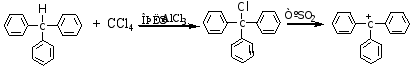
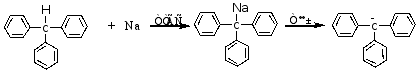 2.性质
2.性质
3.游离基及正、负离子的稳定性
这是由于形成的大Π键使电子、正电荷、负电荷离域被三个苯基分散的结果。
(三)非苯芳烃
一)、休克尔规则
一百多年前,凯库勒就预见到,出了苯外,可能存在其他具有芳香性的环状共轭多烯烃。为了解决这个问题,化学家们作了许多努力,但用共价键理论没有很好的解决这个问题。
1931年,休克尔(E.Huckel)用简单的分子轨道计算了单环多烯烃的π电子能级,从而提出了一个判断芳香性体系的规则,称为休克尔规则。
休克尔提出,单环多烯烃要有芳香性,必须满足三个条件。
(1) 成环原子共平面或接近于平面,平面扭转不大于0.1nm;
(2) 环状闭合共轭体系;
(3) 环上π电子数为4n+2 (n= 0、1、2、3……);
符合上述三个条件的环状化合物,就有芳性,这就是休克尔规则。
 例如:
例如:
其他不含苯环,π电子数为4n+2的环状多烯烃,具有芳性,我们称它们为非苯系芳烃。
二)、非苯芳烃
1.具有芳香性的离子
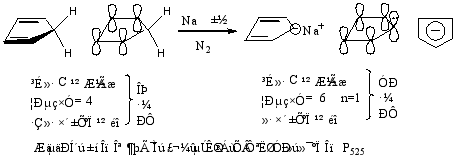 (1) 戊二烯负离
(1) 戊二烯负离
(2) 环庚三烯正离子

(3) 环辛四烯双负离子
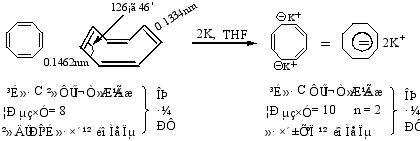
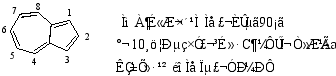 2.薁
2.薁
薁有明显的极性,其中五元环是负性的,七元环是正性的,可表示如下:
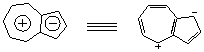
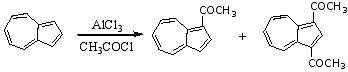 薁有明显的芳香性,表现在能起亲电取代反应上。例如,薁能起酰基化反应,取代基进入1,3-位:
薁有明显的芳香性,表现在能起亲电取代反应上。例如,薁能起酰基化反应,取代基进入1,3-位:
薁的衍生物如1,4-二甲基-7-异丙基薁存在于香精中,若含有万分之一时,就显蓝色,它又叫愈创蓝油烃,是治疗烧伤、烫伤和冻疮的药物。
3.轮烯
具有交替的单双键的多烯烃,通称为轮烯。轮烯的分子式为(CH)X,χ≥10,命名是将碳原子数放在方括号中,称为某轮烯。例如:χ=10的叫[10]轮烯。
轮烯有否芳性,决定于下列条件:
a.π电子数符合4n+2规则。
b.碳环共平面(平面扭转不大于0.1nm。
c.轮内氢原子间没有或很少有空间排斥作用。
(1)[10]轮烯

(2) [14] 轮烯
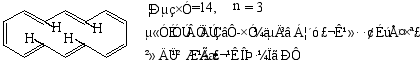
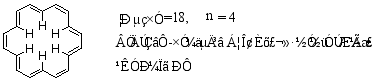 (3)[18] 轮烯
(3)[18] 轮烯
[18]轮烯受热至230℃任然稳定,可发生溴代,硝化等反应,足可见其芳性。
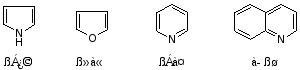 4.杂环化合物
4.杂环化合物
上述杂环化合物都符合休克尔规则,故都有芳性。见第十四章
·1·